Deux essais cliniques de phase 3 au plan expérimental identique ont mesuré la baisse du poids chez des patients âgés de 6 ans et plus et atteints de déficits en POMC, en PCSK1 ou en LEPR1

CONCEPTION DE L’ÉTUDE
L’innocuité et l’efficacité d’IMCIVREE pour la prise en charge du poids chez des patients adultes et enfants d’âge ≥ 6 ans et plus et atteints d’obésité due à un déficit en POMC, en PCSK1 ou en LEPR ont été évaluées lors de deux études de conception identique et menées en ouvert, chacune comprenant une période de sevrage à double insu de 8 semaines.
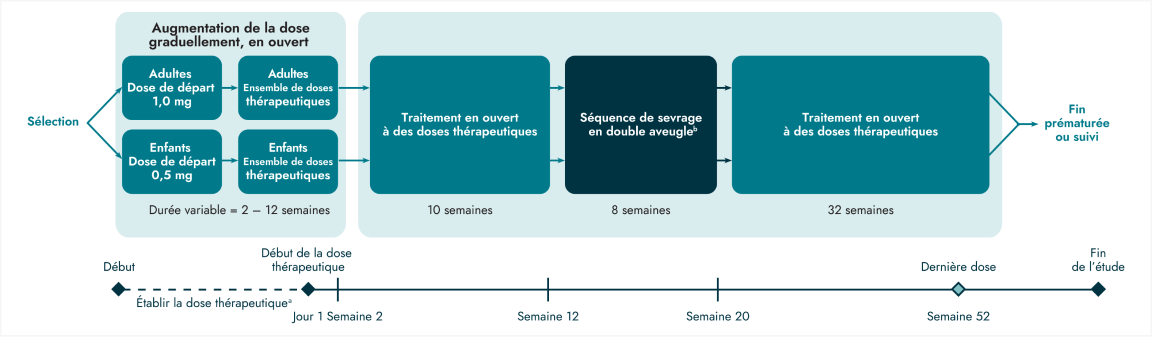
a L’innocuité et l’efficacité d’IMCIVREE pour la prise en charge du poids chez des patients adultes et enfants d’âge ≥ 6 ans et plus et atteints d’obésité due à un déficit en POMC, en PCSK1 ou en LEPR ont été évaluées lors de deux études de conception identique et menées en ouvert, chacune comprenant une période de sevrage à double insu de 8 semaines.
b Consécutivement à la phase de traitement en ouvert de 12 semaines, les participants étant parvenu à un seuil de perte pondérale minimale d’au moins 5 kg (ou perte pondérale ≥ 5 % pour les participants de poids < 100 kg au début de l’étude) sont entrés dans une séquence de 8 semaines de sevrage contrôlée contre placebo menée à double insu. Les participants ont été traités par setmélanotide pendant 4 semaines et par placebo pendant 4 semaines lors de cette phase. Cette séquence de traitement n’a pas été randomisée.
Efficacité durant l'essai POMC, PCSK1, LEPR
Chez les patients d’âge ≥ 6 ans et présentant un déficit en POMC, en PCSK1 ou en LEPR, une proportion significative de patients a obtenu une perte de poids ≥ 10 % à la semaine 52.1

* IC à 90 % : 61,46 – 97,40
† IC à 90 % : 30,00 – 75,63
† † Les patients d’âge ≥ 12 ans qui étaient en mesure d’effectuer une auto-évaluation de leur faim ont consigné quotidiennement leur niveau de faim maximal dans un journal quotidien et ont calculé leurs scores hebdomadaires moyens à des fins d’analyses. Le score reflétant la faim la plus élevée a été obtenu grâce à la question « Au cours de 24 dernières heures, à quel point avez-vous ressenti de la faim lorsque celle-ci était au plus haut? » La faim a été évaluée sur une échelle de 11 points, comprise entre 0 (« aucune faim ») et 10 (« la faim la plus élevée possible »).2
Sécurité durant l'essai POMC, PCSK1, LEPR
IMCIVREE possède un profil d’innocuité et de tolérabilité bien établi.
Effets indésirables se manifestant chez ≥ 5 % des patients traités par IMCIVREE lors de l’essai clinique sur le déficit en POMC, en PCSK1 et en LEPR.1
| IMCIVREE (n=30) | |
|---|---|
| Réaction au site d'injection* | 90% |
| Hyperpigmentation cutanée† | 57% |
| Nausées | 53% |
| Maux de tête | 50% |
| Diarrhée | 40% |
| Érection spontanée du pénis‡ | 40% |
| Douleur abdominale§ | 33% |
| Vomissements | 33% |
| Maux de dos | 30% |
| Nævus mélanocytaire | 30% |
| Fatigue | 27% |
| Dépression‖ | 23% |
| Asthénie | 23% |
| Étourdissements | 17% |
| Vertige | 13% |
| Sécheresse buccale | 13% |
| Frissons | 10% |
| Anxiété | 10% |
| Alopécie | 10% |
| Érythème | 7% |
| Hyperhidrose | 7% |
| Éruptions papuleuse | 7% |
* Comprend érythème, prurit, œdème, douleur, induration, ecchymose, hypersensibilité, hématome, nodule et décoloration au site
d’injection.
† Comprend hyperpigmentation cutanée, nævus mélanocytaire et des troubles de la pigmentation
‡ n = 15 patients masculins.
§ Comprend douleurs abdominales et douleurs dans la partie supérieure de l'abdomen.
‖ Comprend dépression et humeur dépressive.
Cliquez ici pour consulter les mises en garde et précautions associées à IMCIVREE.
Injection sous-cutanée une fois par jour qui peut être administrée à domicile1
Titrer IMCIVREE jusqu’à la dose recommandée.
Chez les patients âgés de 6 à 17 ans:1
- La dose initiale de setmélanotide est de 0,5 mg (0,05 mL), administrée par injection sous-cutanée une fois par jour, pendant 2 semaines.
- Surveiller les effets indésirables GI pour ajuster la posologie.
- Il est possible d’augmenter la dose quotidienne par paliers de 0,5 mg toutes les 2 semaines, si bien toléré, jusqu’à une dose maximale quotidienne de 2,0 mg.
- Si la dose initiale n’est pas tolérée, IMCIVREE doit être cessé.
Chez les patients âgés de ≥ 18 ans:1
- La dose initiale de setmélanotide est de 1 mg (0,1 mL), administrée par injection sous-cutanée (SC) une fois par jour (DIE), pendant 2 semaines
- Surveiller les effets indésirables gastro-intestinaux (GI) pour ajuster la posologie
- Il est possible d’augmenter la dose quotidienne par paliers de 0,5 mg toutes les 2 semaines, si bien toléré, jusqu’à une dose maximale quotidienne de 3,0 mg
- Si la dose initiale n’est pas tolérée, il faut arrêter le traitement par IMCIVREE
IMCIVREE doit être administré une fois par jour, en début de journée, indépendamment de l’heure des repas – l’administration n’exige aucune prise de nourriture.1
Aucune modification posologique n’est nécessaire chez les patients présentant une insuffisance rénale légère ou modérée.1
Pour les patients adultes et les patients pédiatriques âgés de 12 ans et plus atteints d’insuffisance rénale grave (DFGe de 15 à 29 mL/min/1,73 m2):1
- La dose initiale de setmélanotide est de 0,5 mg (0,05 mL) DIE, administrée par injection sous-cutanée pendant 2 semaines. Surveiller les effets indésirables GI chez les patients
- Il est possible d’augmenter la dose quotidienne par paliers de 0,5 mg toutes les 2 semaines, si bien toléré, jusqu’à une dose maximale quotidienne de 1,5 mg
- Si la dose initiale n’est pas tolérée, il faut arrêter le traitement par IMCIVREE
Considérations posologiques:1
- IMCIVREE doit être prescrit et supervisé par un médecin ayant une expertise en obésité présentant une étiologie génétique sous-jacente
- IMCIVREE doit être administré une fois par jour, en début de journée, indépendamment de l'heure des repas
- Pour un traitement par IMCIVREE, sélectionner les patients ayant un déficit de POMC, PCSK1 ou LEPR génétiquement confirmé ou un diagnostic clinique de BBS
- Évaluer régulièrement la réponse au traitement par IMCIVREE
- Chez les patients ayant un déficit en POMC, en PCSK1 ou en LEPR, évaluer la perte de poids après 22 semaines de traitement. Cesser le traitement par IMCIVREE chez un patient qui n’a pas terminé sa croissance, et n’a pas perdu au moins 5 % de son poids initial ou 5 % de son IMC initial, car il est peu probable que ce patient puisse obtenir et maintenir une perte de poids cliniquement significative en poursuivant le traitement
- Chez les patients pédiatriques, évaluer l'impact de la perte de poids sur la croissance et la maturation
Amorcer le traitement par IMCIVREE chez votre patient
- Le Formulaire d’inscription Rhythm EnHarmonie est disponible ici ou auprès des responsables Rhythm de votre territoire.
- Suivez les instructions pour remplir ce formulaire.
- Envoyez toutes les pages du formulaire rempli par télécopie au 1 833-350-3887 ou par courriel à l’adresse [email protected].
Un soutien financier pourrait être disponible pour les patients admissibles et pour lesquels le traitement par IMCIVREE est indiqué. Pour les questions sur IMCIVREE et le processus de démarrage du traitement d’un patient, appelez Rhythm EnHarmonie au 1 833-654-2155 du lundi au vendredi, de 8 h à 20 h, heure de l’Est.
Soutien aux patients et ressources
Dans cette section, vous trouverez des informations sur les ressources éducatives élaborées par Rhythm.
Nous continuerons à mettre à jour cette page avec des ressources supplémentaires sur les maladies rares de la voie du récepteur de la mélanocortine de type 4 (MC4R).
Références:
1. IMCIVREE (setmelanotide solution for subcutaneous injection) Product Monograph. Rhythm Pharmaceuticals Inc. May 4, 2023. 2. Clément K et al. Lancet Diabetes Endocrinol. [Supplementary Appendix] 2020;8(12):960-970.






