IMCIVREE est le premier médicament à faire l'objet de plusieurs essais cliniques de phase 3 consacrés à la réduction du poids chez les patients atteints du SBB ou de déficience en POMC, PCSK1 ou LEPR.1,2

IMCIVREE, un agoniste du MC4R, a été conçu pour rétablir l’activité de la voie du MC4R1
La voie du récepteur hypothalamique de la mélanocortine de type 4 (MC4R) est une voie de signalisation principale responsable de la régulation de la faim, de la satiété et de la dépense énergétique.2
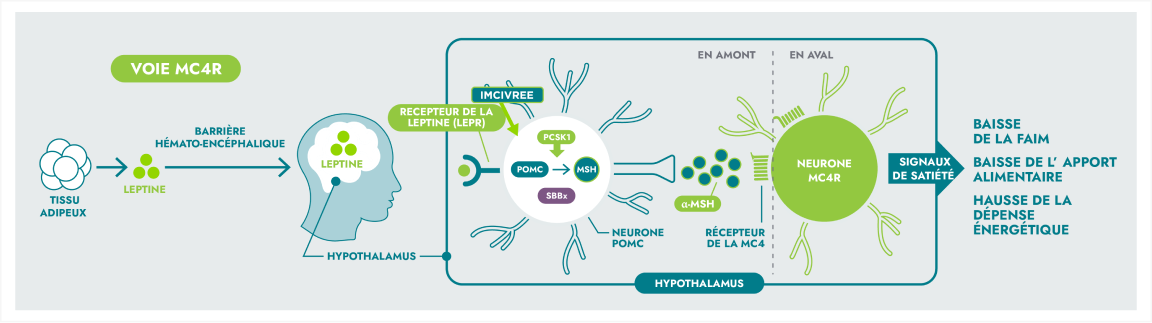
Des variants génétiques rares de la voie MC4R peuvent entraîner une altération de la signalisation neuronale, conduisant à des maladies rares de la voie MC4R.3,4
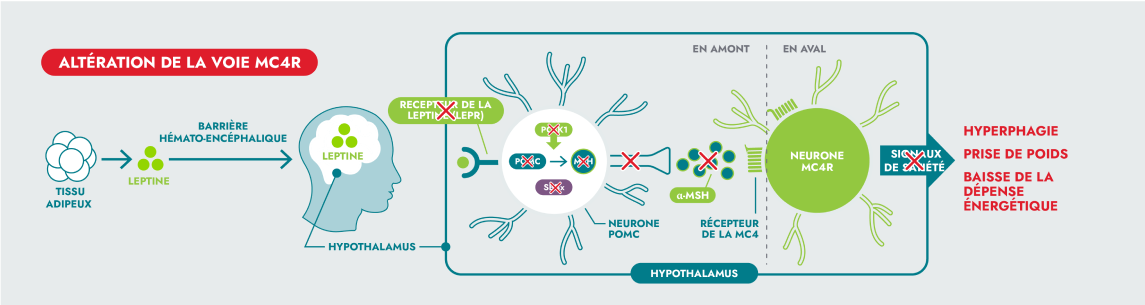
IMCIVREE est le premier médicament évalué dans plusieurs essais cliniques de phase 3 dédiés à l’hyperphagie (faim insatiable, pathologique) et à l’obésité chez des patients atteints d’un SBB ou d’un déficit en POMC, en PCSK1 ou en LEPR.5,6
IMCIVREE a permis une perte de poids importante et cliniquement significative sur 1 année.5,6
Indications et restrictions d’emploi1
IMCIVREE (solution de setmélanotide pour injection sous-cutanée) est indiqué pour la prise en charge du poids chez les patients adultes et les enfants âgés de 6 ans et plus atteints d’obésité due à:
- Syndrome de Bardet-Biedl (SBB)
- Un déficit biallélique confirmé génétiquement en pro-opiomélanocortine (POMC), en proprotéine convertase subtilisine/kexine de type 1 (PCSK1) ou en récepteur de la leptine (LEPR) dû à des variants interprétés comme étant pathogènes, probablement pathogènes ou de signification indéterminée
Limitations de l’utilisation :
La setmélanotide n'est pas indiquée pour le traitement des patients présentant les affections suivantes, car la setmélanotide ne devrait pas être efficace:
- Obésité due à un déficit soupçonné en POMC, PCSK1 ou LEPR causé par des variants en POMC, PCSK1 ou LEPR classées comme bénignes ou probablement bénignes
- Autres types d'obésité non liés à un déficit en POMC, PCSK1 ou LEPR, ou au BBS, y compris l'obésité associée à d'autres syndromes génétiques et l'obésité générale (polygénique)
Enfants et Personnes âgées
Enfants (< 6 ans) :
Santé Canada ne dispose d’aucune donnée; par conséquent, Santé Canada n’a autorisé aucune indication chez les enfants de moins de 6 ans.
Enfants et adolescents (6 à 17 ans) :
D’après les données examinées par Santé Canada, l’innocuité et l’efficacité d’IMCIVREE ont été démontrées dans la population pédiatrique (6 à 17 ans). Par conséquent, Santé Canada a autorisé une indication d’utilisation dans la population pédiatrique.
Personnes âgées :
Les études cliniques évaluant IMCIVREE ne comprenaient pas des patients âgés de 65 ans et plus. On ignore si les patients gériatriques répondraient différemment des patients adultes plus jeunes.
IMCIVREE est généralement bien toléré. Parmi tous les patients, les événements indésirables liés au traitement les plus rapportés ont été les suivants : réactions au site d’injection, hyperpigmentation cutanée, érection spontanée du pénis, nausées, céphalée, diarrhée, douleurs abdominales, vomissements, nævus mélanocytaire, douleurs au dos, fatigue, dépression, asthénie, étourdissements et sécheresse buccale.1
Cliquez ici pour consulter les mises en garde et précautions associées à IMCIVREE.
Contraindications :
Patients qui présentent une hypersensibilité à ce médicament ou à l’un des ingrédients de la formulation de ce dernier, incluant les ingrédients non médicinaux, ou à un composant du contenant.
Références:
1. IMCIVREE (setmelanotide solution for subcutaneous injection) Product Monograph. Rhythm Pharmaceuticals Inc. May 4, 2023. 2. Eneli I et al. Appl Clin Genet. 2019;12:87-93. 3. Yazdi FT et al. PeerJ. 2015;3:e856. 4. Huvenne H et al. Obes Facts. 2016;9(3):158-173. 5. Clément K et al. Lancet Diabetes Endocrinol. 2020;8(12):960-970. 6. Haqq AM, et al. Lancet Diabetes Endocrinol. 2022;10(12):859-868.
