Les déficits en POMC, en PCSK1 et en LEPR sont des maladies génétiques rares associées à l’obésité
Les variants génétiques de la voie du récepteur de la mélanocortine de type 4 (MC4R) peuvent altérer la régulation de la faim, de l’apport alimentaire, de la satiété et de la dépense énergétique.1,2
Une signalisation du MC4R déficiente peut conduire à l’hyperphagie (faim insatiable, pathologique) et à une obésité sévère précoce, indépendamment des facteurs liés à l’environnement et au mode de vie.3,4
Les déficits en pro-opiomélanocortine (POMC), en proprotéine convertase subtilisine/kexine de type 1 (PCSK1) et en récepteur de la leptine (LEPR) sont des maladies héréditaires autosomiques récessives causées respectivement par des variants du gène POMC, du gène PCSK1 et du gène LEPR.4,5
| Caractéristiques cliniques principales | Déficit en POMC6-9 | Déficit en PCSK16,10,11 | Déficit en LEPR6,12,13 |
|---|---|---|---|
|
|||
| Autres caractéristiques cliniques possibles |
|
|
|
POMC, proopiomélanocortine; PCSK1, proprotéine convertase subtilisine/kexine de type 1; LEPR, récepteur de leptine.
Des tests génétiques sont nécessaires pour confirmer le diagnostic
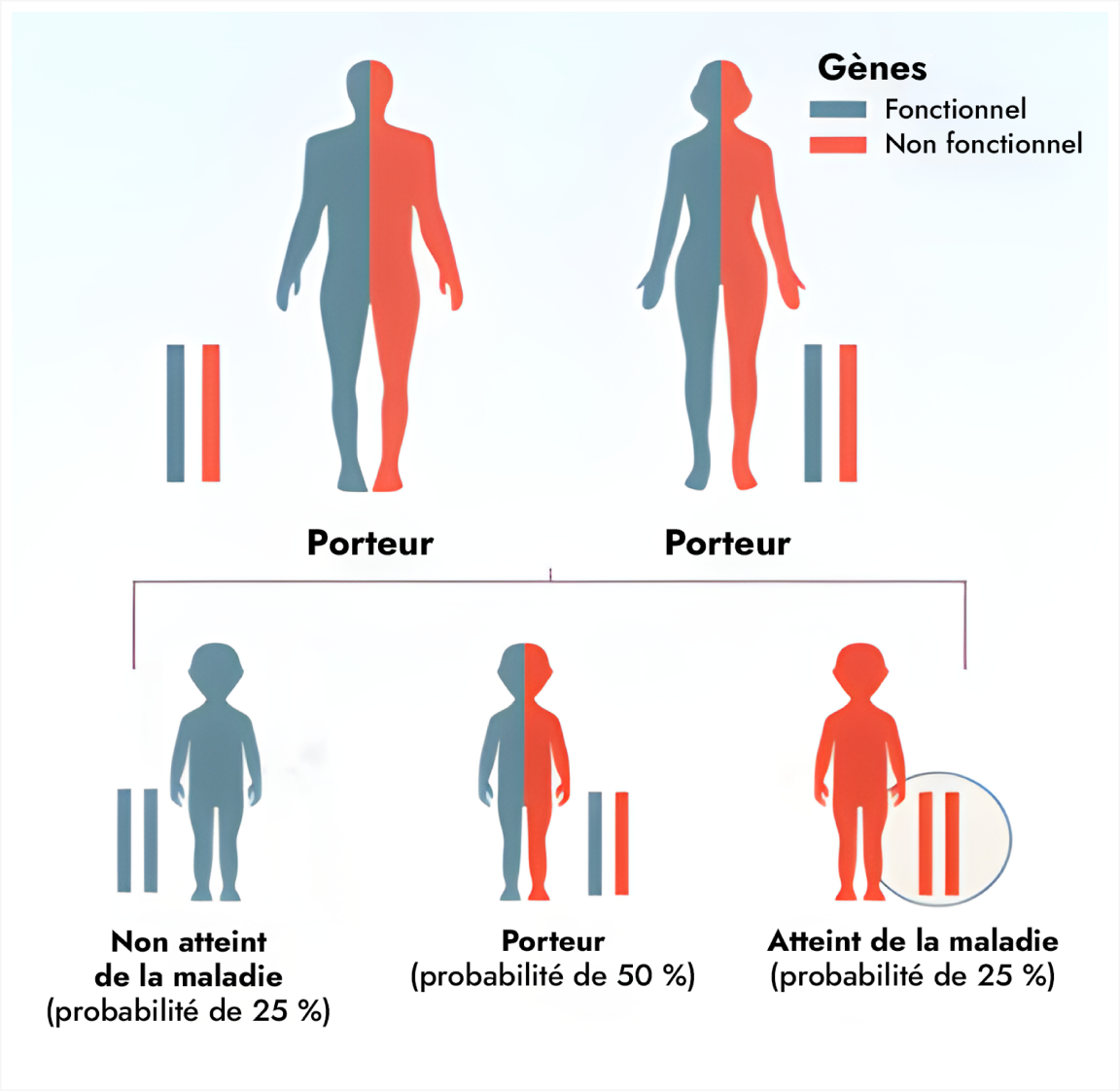
Les déficits en POMC, en PCSK1 et en LEPR sont monogéniques et nécessitent des tests génétiques pour en confirmer le diagnostic.14 Ce sont également des maladies héréditaires autosomiques récessives, ainsi les personnes atteintes possèdent un variant au niveau des deux copies (allèles) du gène.14
Références:
1. Yazdi FT et al. PeerJ. 2015;3:e856. 2. Acosta A et al. Genes Nutr. 2014;9:384. 3. Haqq AM et al. Lancet Diabetes Endocrinol. 2022;10:859-868. 4. Huvenne H et al. Obes Facts. 2016;9:158-173. 5. Fonseca ACP et al. Obes Facts. 2016;9:158-173. 6. Styne DM et al. J Clin Endocrinol Metab. 2017;102(3):709-757. 7. Coll AP et al. J Clin Endocrinol Metab. 2004;89(6):2557-2562. 8. Mendiratta MS et al. Int J Pediatr Endocrinol. 2011;2011(1):5. 9. Argente J et al. Endocr Abstr. 2019;63:P976. 10. Stijnen P et al. Endocr Rev. 2016;37(4):347-371. 11. Martin MG et al. Gastroenterology. 2013;145(1):138-148. 12. Farooqi IS O’Rahilly S. J Endocrinol. 2014;223(1):T63-T70. 13. Thaker VV. Adolesc Med State Art Rev. 2017;28(2):379-405. 14. Online Mendelian Inheritance in Man. Entries 609734, 600955, and 614963. https://www.omim.org/.
Accessed November 18, 2021.
